Wasserstoff hat eine Energiedichte von 33.3 kWh/kg und wird in Abhängigkeit von Elektrolyseurart und -betriebsweise mit einer Effizienz von ca. 50 – 80 % produziert. Entsprechend müssen für die Erzeugung eines kg H2 ca. 42 – 66.7 kWh Energie aufgebracht werden. Im Folgenden werden die Erzeugung von Wasserstoff per Wasserelektrolyse und die gängigsten Arten der Wasserelektrolyse dargestellt.
In der Wasserelektrolyse wird durch das Anlegen einer elektrischen Spannung Wasser (H2O) in Wasserstoff (H2) und Sauerstoff (O2) gespalten. Somit handelt es sich um eine elektrochemische Reaktion. Die Reaktionsgleichung der Wasserelektrolyse lautet[1, 2]:
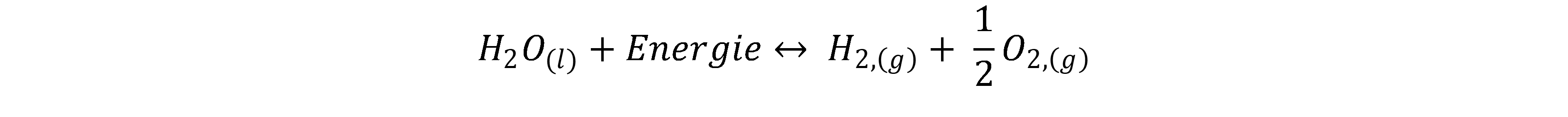
Die Reaktion teilt sich in zwei Halbzellenreaktionen auf, welche jeweils an der Kathode und Anode ablaufen. Die beiden Elektroden sind in einem Elektrolyten eingetaucht. Die gängigsten Arten der Wasserelektrolyse werden durch die Art des Elektrolyten unterscheiden.
Diese Elektrolysearten sind:
- Polymerelektrolytmembran-Elektrolyse (PEM)
- Alkalische Elektrolyse (AEL)
- Festoxid-Elektrolyse (SOEC, Solid-Oxide-Electrolysis-Cell)
Polymerelektrolytmembran-Elektrolyse (PEM)
In der PEM-Elektrolyse wird eine protonenleitende, gasundurchlässige Membran verwendet. Flüssiges Wasser wird der Anode zugeführt und dort in Sauerstoff und Protonen (H+) gespalten.[2, 3]
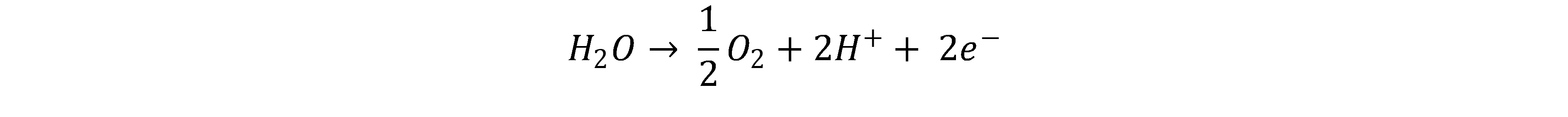
Die Protonen diffundieren durch die Membran zur Kathode und werden dort mit Elektronen zu Wasserstoff kombiniert.[3,5]
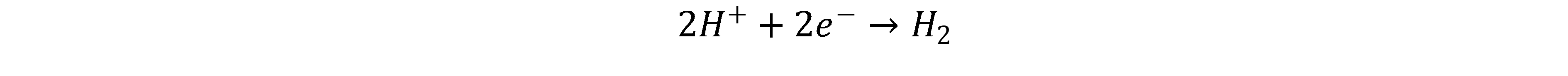
Der Vorteil der PEM-Elektrolyse liegt in dem sehr dynamischen Verhalten, welches sich im Vergleich zur AEL besser zur Koppelung mit fluktuierenden erneuerbaren Energieanlagen eignet. Außerdem ist eine hohe Reinheit des Wasserstoffs auch im Teil- und Überlastbetrieb gegeben. Zudem sind höhere Stromdichten, verglichen mit der AEL, möglich. Zu den Nachteilen zählen die hohen Kosten und der Bedarf an teuren und seltenen Katalysatormaterialien. Hier sind Platin, Iridium und Ruthenium zu nennen. Diese werden benötigt, da es die einzigen Materialien sind, die im sauren Milieu der PEM aktiv und langzeitstabil sind.[3]
Alkalische-Elektrolyse (AEL)
Bei der alkalischen Elektrolyse wird das Wasser meist an zwei nickelbasierten Elektroden gespalten. Diese sind durch ein Diaphragma getrennt, welches den Durchtritt von Gasblasen verhindert, den Elektrolyten Kalilauge (KOH((aq))), aber passieren lässt.[2,4]
Bei der alkalischen Elektrolyse entstehen an der Kathode aus Wasser unter Elektronenaufnahme Hydroxidionen und Wasserstoff.[3,4]

Die Hydroxidionen wandern auf Grund des Ladungsunterschieds zur Anode und reagieren dort unter Elektronenabgabe zu Wasser und Sauerstoff.[2, 4]
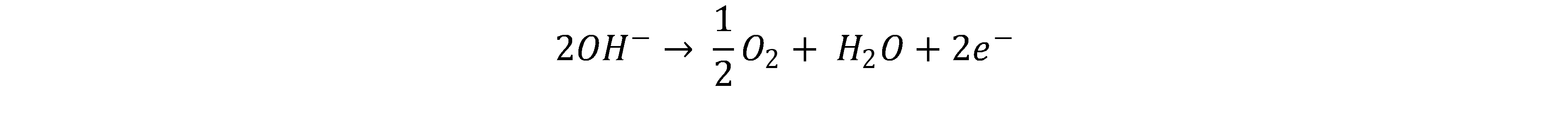
Da die alkalische Elektrolyse eine hohe Marktreife besitzt, sind die Investitionskosten im Vergleich zur PEM gering. Zudem besitzen alkalische Elektrolyseure eine sehr gute Langzeitstabilität. Das basische Milieu erlaubt den Einsatz günstigerer Materialien, es besteht kein Bedarf an seltenen Erden, oder Edelmetallen.
Die Nachteile der AEL liegen in der geringen Stromdichte, verglichen mit der PEM-Elektrolyse, was zu größeren Gesamtanlagen führt. Außerdem bestehen bei einem dynamischen Betrieb der AEL Probleme im unteren Lastbereich.
Festoxid-Elektrolyse (SOEC)
Bei der Festoxid-Elektrolyse (Solid-Oxid-Electrolysis-Cell, SOEC) wird typischerweise eine oxidionenleitende (O2-) Keramik als Elektrolyt und Separator eingesetzt. Diese wird erst ab einigen hundert °C ausreichend leitfähig, weshalb SOEC für gewöhnlich zwischen 500 – 900 °C betrieben wird und somit eine Form der Hochtemperaturelektrolyse darstellt. Bei der SOEC wird Wasserdampf an der Kathode in Wasserstoff und Oxidionen aufgespalten.[5]

Die Oxidionen diffundieren durch den Festkörperelektrolyten und werden an der Anode zu elementarem Sauerstoff oxidiert.
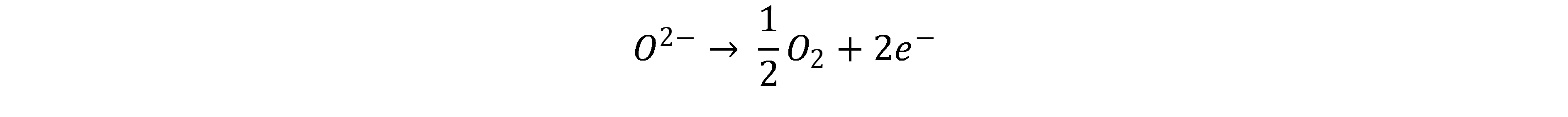
Ein Vorteil der SOEC liegt in einer höheren Effizienz verglichen mit PEM und AEL. Diese resultiert aus der Temperaturabhängigkeit der freien Reaktionsenthalpie, bei höheren Temperaturen kann zunehmend elektrische durch thermische Energie substituiert werden. Je nach Betriebspunkt kann diese thermische Energie selber produziert, oder von außen zugeführt werden. Wird Wärme von außen zugeführt, können, bezogen auf die eingesetzte Menge elektrischer Energie, Wirkungsgrade >1 erzielt werden.
Die hohen Temperaturen führen allerdings auch zu erhöhtem Materialverschleiß (insbesondere bei dynamischem Betrieb) und langen An- und Abschaltzeiten. Im Vergleich zu alkalischer Elektrolyse ist die SOEC noch relativ neu und muss insbesondere bei Langzeitstabilität aufholen. Bei Ressourcenverfügbarkeit ist SOEC zwischen PEM und AEL einzuordnen, es werden seltene Erden benötigt, welche zwar nicht so teuer wie Edelmetalle sind, aber zu einer strategischen Abhängigkeit führen könnten.
Referenzen:
- Shiva Kumar, S.; Himabindu, V. Hydrogen production by PEM water electrolysis – A review. Materials Science for Energy Technologies 2019, 2 (3), 442–454. DOI: 10.1016/j.mset.2019.03.002.
- David, M.; Ocampo-Martínez, C.; Sánchez-Peña, R. Advances in alkaline water electrolyzers: A review. Journal of Energy Storage 2019, 23, 392–403. DOI: 10.1016/j.est.2019.03.001.
- Universität Augsburg. Polymerelektrolytmembran - Elektrolyse (PEM). https://www.uni-augsburg.de/de/forschung/einrichtungen/institute/amu/wasserstoff-forschung-h2-unia/h2lab/h2-er/elektrolyse/pem/ (accessed 2023-04-03).
- Universität Augsburg. Alkalische Elektrolyse (AEL). https://www.uni-augsburg.de/de/forschung/einrichtungen/institute/amu/wasserstoff-forschung-h2-unia/h2lab/h2-er/elektrolyse/ael/ (accessed 2023-04-03).
- Universität Augsburg. Hochtemperatur (Feststoffoxid) Elektrolyse. https://www.uni-augsburg.de/de/forschung/einrichtungen/institute/amu/wasserstoff-forschung-h2-unia/h2lab/h2-er/elektrolyse/th-el/ (accessed 2023-04-03).